Physiopathologie de la Prolactine et de l'Hormone de croissance
Notre équipe se distingue par son expertise dans les approches translationnelles visant à élucider les mécanismes cellulaires et moléculaires complexes sous-jacents à la progression et la résistance au traitement des cancers du sein et de la prostate. Nous mettons un accent particulier sur l'étude de la signalisation hormones/cytokines et de la régulation métabolique, notamment en ce qui concerne le fer, et leur influence sur la plasticité des cellules épithéliales.
Face à l'augmentation de l'incidence du cancer liée à l'allongement de l'espérance de vie, nous accordons une importance capitale au diagnostic et à l'intervention précoces. Pour les tumeurs du sein localisées et les tumeurs de la prostate , les traitements chirurgicaux et la radiothérapie combinés à des mesures préventives comme le dépistage et la mammographie, se sont avérés efficaces. Toutefois, à mesure que ces maladies évoluent vers des stades plus complexes, nous observons un passage de la prise en charge standard à l'hormonothérapie (les anti-androgènes et les anti-oestrogènes), avec un défi majeur, la résistance au traitement.
Nos recherches s'articulent autour de trois thèmes principaux :
- Progression du cancer de la prostate (Vincent Goffin, Jacques-Emmanuel Guidotti et Charles Dariane)
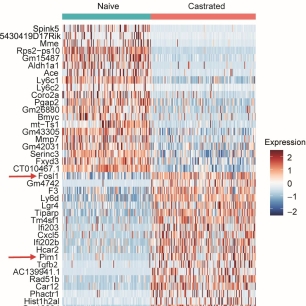
En collaboration avec un consortium de biologistes, bioinformaticiens et cliniciens, nous cherchons à étudier et cibler les mécanismes qui favorisent l'expansion de cellules souches luminales dans des contextes de castration. Nous visons à évaluer la pertinence de ces découvertes dans des échantillons de cancer de la prostate humain. Ce projet est soutenu par une subvention de l'Institut National du Cancer (INCa) de novembre 2021 à octobre 2025.
- Hyperplasie bénigne de la prostate (Vincent Goffin et Nicolas Barry-Delongchamps)
Au sein d'un consortium de biologistes, immunologistes et cliniciens, nous nous efforçons de cartographier les interactions moléculaires et cellulaires entre les progéniteurs luminaux et les cellules immunitaires infiltrantes, orchestrées par une signalisation STAT5 chronique dans l'hyperplasie bénigne de la prostate. Nous explorerons également la pertinence de ces découvertes dans des échantillons humains de HBP. Ce projet est soutenu par une subvention de l'Agence Nationale de la Recherche (ANR) de mars 2023 à septembre 2026.
- Recherche sur le cancer du sein (Ahmed Hamai)
Dans ce projet, nous étudions le métabolisme du fer et les mécanismes moléculaires déclenchant la ferroptose dans les cellules souches du cancer du sein. De plus, nous explorerons le rôle de l'autophagie dans la plasticité associée à la cellule souche à l'aide de modèles précliniques de cancer du sein. Les coûts opérationnels de ce projet ont été généreusement soutenus pendant cinq ans par la 'Ligue contre le cancer' jusqu'en décembre 2024.
Avec nos initiatives de recherche, nous sommes engagés à approfondir notre compréhension du cancer et à développer des approches innovantes pour le traitement et les soins aux patients.